Alors que le début du millénaire a été marqué par les pandémies du SRAS en 2002 et de la grippe H1N1 en 2009, l’émergence récente du SARS-CoV-2, causant la pandémie de la COVID-19, a démontré une fois de plus le besoin criant de technologies permettant le développement rapide de vaccins efficaces et sécuritaires (1). Dans ce contexte, les assemblages protéiques pourraient constituer un élément clé dans le développement de plateformes de vaccination universelles permettant de prévenir la propagation de virus. Plusieurs études ont montré que, contrairement aux vaccins courants, ces assemblages ne présentent aucun risque de complication et induisent une réponse immunitaire élevée. En effet, ces nano-vaccins permettent une production accrue d’anticorps par l’organisme pour neutraliser le virus d’intérêt. Certaines permettent même une réponse dite cytotoxique, qui permet d’éliminer les cellules infectées (2). Bien que ces nouvelles technologies ne soient pour la plupart pas encore testées chez les humains, plusieurs études précliniques indiquent qu’elles confèrent une protection allant jusqu’à 100% de la population vaccinée (3). L’efficacité de la réponse immunitaire est toutefois dépendante de plusieurs paramètres tels que la structure, la forme, la taille, la capacité des assemblages à activer les cellules immunitaires et bien sûr, des antigènes à leur surface (4).
Des vaccins à réinventer
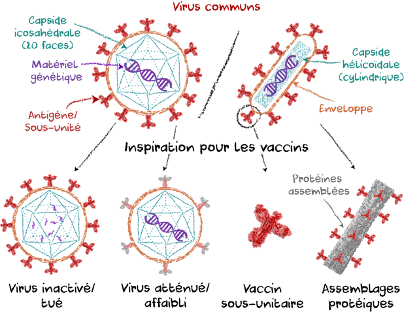
Les vaccins les plus couramment utilisés incluent les virus vivants atténués/affaiblis et les virus entiers inactivés/tués (Figure 1). Alors que les premiers présentent des risques de complications, notamment chez les personnes immunodéprimées, les seconds peuvent être faiblement immunogènes. Ceux-ci nécessitent donc des doses de rappel, ou encore la co-administration d’adjuvants, substances augmentant la réponse immunitaire, mais parfois associées à des effets secondaires. Le stockage de ces vaccins au froid peut aussi s’avérer ardu dans certaines régions du monde. Les vaccins sous-unitaires, composés seulement d’antigènes viraux, bien qu’ils évitent les complications et contournent les problèmes de stockage, restent peu immunogènes (5). Les assemblages protéiques, dérivés des vaccins sous-unitaires, sont biodégradables, mais robustes, ne présentent aucun risque d’infection et induisent une forte réponse immunitaire. Ces nano-vaccins sont composés de plusieurs copies de protéines hybrides, elles-mêmes composées de deux parties : un antigène, petite protéine virale cible du système immunitaire (Figure 1), et une protéine d’autoassemblage. Cette dernière permet à plusieurs copies de protéines hybrides de s’assembler spontanément en nanoparticules imitant les virus.
Imiter les virus
La capacité de ces nanoparticules à induire une réponse immunitaire est en partie dépendante de leur aptitude à imiter les pathogènes naturels (ex. virus, bactéries), sans causer elles-mêmes de maladies. En général, les protéines s’assemblent en suivant des motifs moléculaires définis, comme les feuillets-β croisés et les coiled-coils (Figure 2). Les feuillets-β croisés, composés de feuillets protéiques, un peu à l’image des mille-feuilles, permettent de former de longues fibres non branchées (6,7). Ces structures peuvent être retrouvées chez des pathogènes, comme dans les biofilms bactériens, et permettent l’activation des récepteurs des cellules immunitaires (PRRs), qui reconnaissent naturellement les motifs associés aux bactéries et virus (8). C’est pourquoi plusieurs nano-vaccins utilisent les assemblages en feuillets-β croisés pour induire une forte réponse immunitaire. Par exemple, des nanofibres composées d’un antigène du virus Chikungunya et d’une partie de protéine (I10) s’assemblant en feuillets induisent une forte production d’anticorps chez les souris sans utilisation d’adjuvants, tel que les sels d’aluminium (9).
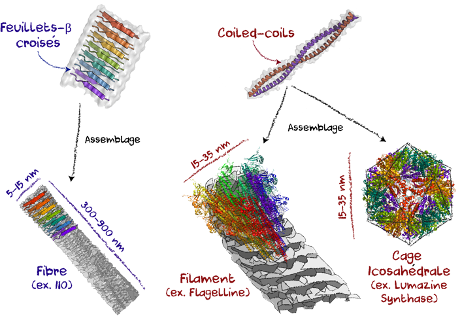
Les coiled-coils, composés d’hélices, comparables à un fil de téléphone enroulé sur lui-même, permettent de former une variété de particules ayant différentes formes et arrangements. Ces motifs sont retrouvés dans plusieurs assemblages naturels, comme les fibres de collagène dans les cheveux. Ils sont aussi retrouvés dans les capsides enveloppant le matériel génétique des virus et les flagelles permettant la mobilité des bactéries (10). Un nano-vaccin utilisant de tels motifs est justement constitué de longs filaments de flagelline, protéine composant le flagelle bactérien (Figure 2). Cet assemblage seul, bien que d’origine bactérienne, ne cause pas d’infections et induit de fortes réponses immunitaires en activant naturellement les PRRs. De récentes études ont montré que de tels filaments liés à des antigènes du virus de la Dengue peuvent être utilisés en vaccination (11). Les coiled-coils permettent aussi de former des cages polyhédrales, par exemple icosahédrales (20 faces), ressemblant aux capsides virales (Figures 1 et 2). C’est le cas des nanoparticules de lumazine synthase, protéine retrouvée chez l’humain, qui peut être liée à des antigènes du VIH pour ainsi être transformée en vaccin sécuritaire (12). D’autres cages icosahédrales liées à des antigènes du parasite de la malaria confèrent une protection totale chez la population vaccinée (13). Ces trois plateformes induisent de fortes réponses en anticorps dirigés spécifiquement contre l’antigène greffé, indiquant leur potentiel pour la vaccination.
Infiltrer le système immunitaire
Pour provoquer une réponse immunitaire adaptative, qui est spécifique et durable, les particules doivent être transportées du site d’injection aux organes du système immunitaire, comme les ganglions lymphatiques, et internalisées par les cellules présentatrices d’antigène (CPAs), qui permettent de lier l’immunité innée, non spécifique et instantanée, à l’immunité adaptative. Les tailles optimales pour le transport aux ganglions lymphatiques et l’internalisation par les CPAs peuvent être comprises entre 10 et 2 000 nanomètres (nm) (14). Les fibres de E2EP3-I10, avec une longueur de 300 à 900 nm, les filaments de flagelline, de plusieurs centaines de nm,
et les cages de lumazine synthase, avec un diamètre d’environ 30 nm respectent ces conditions, ce qui pourrait expliquer leur efficacité en vaccination (15,16,17).
Vers des vaccins universels
La plupart du temps, la protéine hybride, contenant l’antigène et la protéine d’assemblage, est produite en un seul morceau, puis assemblée en nanoparticules. Cependant, le développement de nombreuses technologies de conjugaison post-assemblage, impliquant des molécules chimiques ou biochimiques, permet de greffer des antigènes à des nanoparticules préassemblées (18). Ces stratégies pourraient permettre le développement rapide de nouveaux vaccins par la conjugaison d’antigènes spécifiques de différents virus à des plateformes universelles, ayant des caractéristiques structurales, morphologiques, et des propriétés immunologiques résultantes hautement contrôlées. Alors que l’Organisation mondiale de la santé estime que plusieurs virus émergents sont susceptibles de causer de nombreuses crises sanitaires dans les prochaines années (19), de tels nano-vaccins universels constitueraient une arme clé dans la lutte contre de futures pandémies.






1 Comment
Bonjour,
j’aimerai utiliser votre figure 1 dans mon cours. comment puis-je la référencer s’il vous plait?
Merci