L’environnement qui nous entoure change constamment et impacte sans cesse notre corps. Imaginez une sportive courant sur une piste d’athlétisme bien lisse : son corps fonctionne de manière optimale, ses muscles répondent efficacement, et l’impact sur ses articulations est maîtrisé. Maintenant, placez-la sur un sentier de montagne escarpé, jonché de pierres et de racines. Chaque foulée devient un défi, sollicitant son équilibre, ses muscles et sa capacité d’adaptation. Si elle persiste à s’entraîner dans ces conditions, elle développera des compétences qui lui permettront d’évoluer plus facilement sur ce type de terrain. De manière surprenante, les cellules cancéreuses font face à des défis similaires dans leur environnement. Ce faisant, elles apprennent à s’adapter pour survivre, mais cette adaptation peut parfois les rendre plus agressives.
La tumeur : un terrain « dur » pour les cellules
L’environnement dans lequel évoluent nos cellules est appelé la matrice extracellulaire. Elle agit comme un filet de protéines qui entoure les cellules à la manière d’un gel. Ce gel est plus ou moins souple selon les tissus. En effet, s’il est ferme dans les os, il l’est beaucoup moins dans les poumons, car leur matrice extracellulaire a une composition différente. Cependant, dans de nombreux cancers, la matrice extracellulaire devient de plus en plus rigide. Elle devient plus ferme à l’image d’un sol qui se durcit sous nos pieds, car certaines molécules s’accumulent et se lient. Cela forme une masse rigide : une tumeur. C’est pour cette raison que l’autopalpation permet de détecter de manière précoce une masse plus rigide susceptible de correspondre à une tumeur.
Mais cette rigidité ne se contente pas de modifier le terrain : elle agit aussi sur les cellules présentes dans la tumeur. Imaginez des athlètes s’entraînant sur un terrain difficile : ils et elles développent des muscles et deviennent plus fort·e·s pour s’adapter. Cependant, certain·e·s athlètes peuvent aussi utiliser du dopage pour aller encore plus loin. De la même manière, les cellules présentes dans la tumeur développent une capacité à se contracter et à générer des forces pour s’adapter à ce nouvel environnement. Malheureusement, parmi elles, une fraction peut ressembler à des cellules « dopées », qui se contractent encore plus et sont les plus agressives. Il s’agit des cellules cancéreuses qui ont le plus de risques de former des métastases, c’est-à-dire entraîner la propagation de la tumeur ailleurs dans le corps.
Il est donc important de mieux comprendre les caractéristiques des cellules présentent dans les tumeurs, notamment les molécules qu’elles produisent lorsque leur environnement change. Il sera alors possible d’agir sur les cellules les plus agressives pour les empêcher de se propager.
Quelles briques composent une cellule métastatique ?
L’ARN est un messager indispensable de l’information génétique. Nos recherches ont mis en lumière un mécanisme surprenant : certains facteurs d’épissage, des « constructeurs » spécialisés qui assemblent l’ARN, sont très sensibles à la rigidité de l’environnement des cellules. Quand ce terrain devient plus rigide, de nouveaux facteurs d’épissage apparaissent. Résultat : ils produisent des ARN qui rendent les cellules cancéreuses plus agressives.
Mais qu’est-ce que l’épissage alternatif ? Imaginez un jeu de briques Lego. À partir d’un même modèle (le gène), il est possible de construire différentes versions en assemblant les pièces différemment. Ce processus permet à une cellule de produire plusieurs ARN différents, qui influencent directement son comportement (voir Figure 1).
Par exemple, un ARN plus court peut permettre à une cellule tumorale de fabriquer des molécules qui facilitent son entrée dans le système sanguin. Cela augmente le risque de métastases, c’est-à-dire la dispersion du cancer dans le corps. En effet, pour se propager, une cellule cancéreuse métastatique doit d’abord quitter la tumeur d’origine, voyager dans le sang, puis en sortir pour coloniser un nouveau tissu et y former une nouvelle tumeur.
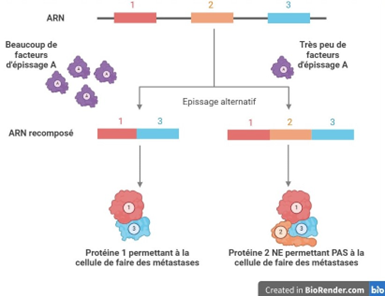
Figure 1 : Les différentes étapes permettant à une cellule de construire une grande diversité d’ARN grâce à l’action des facteurs d’épissage. Ce processus est essentiel, car il a des conséquences sur le niveau d’agressivité des cellules
Étudier les cellules en terrain hostile
Pour comprendre le comportement des cellules cancéreuses sans utiliser d’animaux de laboratoire, nous recréons en laboratoire des environnements similaires à ceux des tumeurs mammaires. À l’aide de techniques d’ingénierie, nous pouvons créer des gels imitant la rigidité des tissus, du plus souple au plus ferme. Ces gels nous permettent d’observer directement le comportement des cellules cancéreuses, comme leur capacité à se contracter ou leur vitesse de déplacement, et de les comparer aux cellules mammaires saines. C’est un peu comme observer des athlètes sur des terrains variés : sur un sol ferme, certain·e·s s’adaptent et excellent, tandis que d’autres peinent à avancer. De la même manière, certaines cellules cancéreuses réagissent à un environnement rigide en devenant plus agressives.
Ensuite, nous analysons les facteurs d’épissage présents dans les cellules les plus agressives. Grâce à des molécules fluorescentes qui ciblent ces facteurs, nous pouvons visualiser leur emplacement et leur quantité au microscope (voir Figure 2). Ces informations nous aident à mieux comprendre comment les facteurs d’épissage réagissent à un environnement plus rigide.
Ces découvertes pourraient nous permettre d’identifier les « cellules dopées » responsables des métastases et de trouver des moyens de les neutraliser. Par exemple, si nous identifions un facteur d’épissage qui joue un rôle très important dans les cellules à fort risque de métastase, nous pourrions utiliser un médicament capable de bloquer ce facteur d’épissage, et par le fait même de bloquer le processus de métastase de la cellule. Bien que nous concentrions nos recherches sur le cancer du sein, cette méthode pourrait être appliquée à d’autres types de cancers.
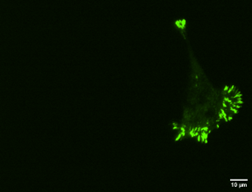
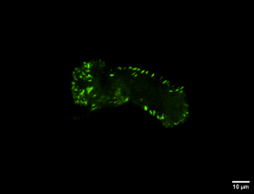
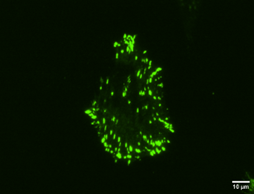
Figure 2 : Cellules à fort potentiel métastatique fixées sur des gels fabriqués en laboratoire. En vert, on observe les points d’ancrage des cellules, qui leur permettent de percevoir les variations de leur environnement et de se déplacer, comme si elles possédaient des centaines de petits pieds. Chaque image représente une cellule distincte, mettant en évidence leur grande diversité.
Rien ne sert de courir, il faut partir à point. La lutte contre le cancer est aussi une course contre-la-montre. En anticipant le développement des cellules cancéreuses grâce à l’examen approfondi de l’environnement de ces cellules, nous pourrions intervenir plus tôt et plus efficacement. Les cellules « dopées » courent vite, mais les recherches en cours pourraient permettre de les couper dans leur élan avant qu’elles aient pris trop de vitesse !
L’autrice tient à remercier Martial Millet, étudiant au doctorat à l’université Laval, pour les images. |
Découvre l'autrice

Juliette Gouhier (elle)
Juliette est étudiante au doctorat en biologie cellulaire et moléculaire à l’Université Laval. Elle fait de la mécanobiologie : elle essaye de comprendre comment les forces physiques qui s’appliquent sur la cellule peuvent influencer son comportement, notamment dans le cancer. Ses moments libres, elle les passe avec ses amis, à faire de la course à pied ou des randonnées dans la nature. Cela l’inspire même dans son projet de recherche !